1) Estructura de la materia:


4) Electrones:
Fue la primera partícula elemental descubierta. Hacia finales del siglo XIX se dedicó un esfuerzo considerable a investigar las descargas eléctricas en los gases enrarecidos.

La materia consiste de
partículas extremadamente pequeñas agrupadas juntas para formar el átomo.
Hay unas 90 ocurrencias naturales de estas agrupaciones de partículas llamadas
elementos. Estos elementos fueron agrupados en la tabla periódica de los elementos en secuencia de acuerdo a sus
números atómicos y peso atómico. Hay además 23 elementos hechos por el hombre
que no ocurren en la naturaleza, por lo que al final son unos 113 elementos
conocidos hasta la fecha. Estos elementos no pueden cambiarse por procesos
químicos. Ellos solo pueden ser cambiados por reacción nuclear o atómica, sin
embargo pueden ser combinados para producir el incontable número de compuestos
con los que tropezamos día a día.
2) Molécula:
Las moléculas están hechas
de átomos de uno o más elementos.
Algunas moléculas están hechas de un sólo tipo de átomo. Por ejemplo, dos
átomos de oxígeno se unen para formar una molécula de O2, la parte del aire que
necesitamos para respirar y vivir. Otras moléculas son muy grandes y complejas.
Por ejemplo, las moléculas de proteína contienen cientos de átomos.
Aún las moléculas muy
grandes son tan pequeñas que no seríamos capaces de ver a una molécula de una
sustancia. Pero cuando cientos de moléculas se encuentran juntas, podrían estar
en forma de un vaso de agua, el árbol de un bosque, la pantalla de la computadora;
dependiendo del tipo de moléculas que sean.

3) Átomo:
Definimos átomo como la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. Aunque el origen de la palabra átomo proviene del griego, que significa indivisible, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas.
Definimos átomo como la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. Aunque el origen de la palabra átomo proviene del griego, que significa indivisible, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas.

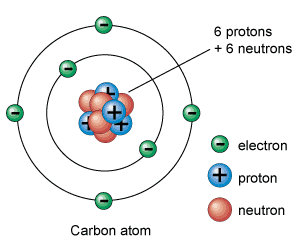
Generalmente, estas partículas subatómicas con las que están formados los átomos son tres: los electrones, losprotones y los neutrones. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.
Los electrones tienen una carga negativa y son las partículas subatómicas más livianas que tienen los átomos. La carga de los protones es positiva y pesan unas 1.836 veces más que los electrones. Los únicos que no tienen carga eléctrica son los neutrones que pesan aproximadamente lo mismo que los protones.
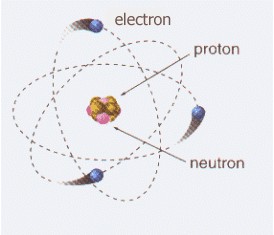
Los protones y neutrones se encuentran agrupados en el centro del átomo formado el núcleo atómico del átomo. Por este motivo también se les llama nucleones. Los electrones aparecen orbitando alrededor del núcleo del átomo.
De este modo, la parte central del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra casi toda su masa, mientras que en el escorzo a, alrededor del núcleo atómico, hay un cierto número de electrones, cargados negativamente. La carga total del núcleo atómico (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total del átomo sea neutra.
Esta descripción de los electrones orbitando alrededor del núcleo atómico corresponde al sencillo modelo de Bohr. Según la mecánica cuántica cada partícula tiene una función de onda que ocupa todo el espacio y loselectrones no se encuentran localizados en órbitas aunque la probabilidad de presencia sea más alta a una cierta distancia del núcleo.
Propiedades de los átomos
Las unidades básicas de la química son los átomos. Durante las reacciones químicas los átomos se conservan como tales, no se crean ni se destruyen, pero se organizan de manera diferente creando enlaces diferentes entre un átomo y otro.
Los átomos se agrupan formando moléculas y otros tipos de materiales. Cada tipo de molécula es la combinación de un cierto número de átomos enlazados entre ellos de una manera específica.
Según la composición de cada átomo se diferencian los distintos elementos químicos representados en latabla periódica de los elementos químicos. En esta tabla podemos encontrar el número atómico y el número másico de cada elemento:
- Número atómico, se representa con la letra Z, indica la cantidad de protones que presenta un átomo, que es igual a la de electrones. Todos los átomos con un mismo número de protones pertenecen al mismo elemento y tienen las mismas propiedades químicas. Por ejemplo todos los átomos con un protón serán de hidrógeno (Z = 1), todos los átomos con dos portones serán de helio (Z = 2).
- Número másico, se representa con la letra A, y hace referencia a la suma de portones y neutrones que contiene el elemento. Los isotopos son dos átomos con el mismo número de protones, pero diferente número de neutrones. Los isótopos de un mismo elemento, tienen unas propiedades químicas y físicas muy parecidas entre sí.

4) Electrones:
Fue la primera partícula elemental descubierta. Hacia finales del siglo XIX se dedicó un esfuerzo considerable a investigar las descargas eléctricas en los gases enrarecidos.
En 1895 Jean Perrin, analizando la carga eléctrica de los
llamados rayos catódicos (catódico), demostró que transportaban carga negativa.
Al poco tiempo, J.J. Thomson llevó a cabo el clásico experimento en el que
consiguió determinar la carga específica de las partículas que constituían,
según él, los rayos catódicos y que llamó electrones. A partir de la relación
carga / masa (e / m) obtenida por Thomson, Millikan, mediante un experimento
hecho célebre, pudo medir en el año 1909 la carga del electrón ey la masa m.
El descubrimiento del electrón inició una nueva etapa de
la física y corroboró la hipótesis de que el electrón es una partícula
elemental del Universo a partir de la cual se forman todos los átomos.
Se ha podido comprobar que la masa del electrón aumenta con la velocidad, de acuerdo con las predicciones de la mecánica relativista. También ha sido verificada la naturaleza ondulatoria del electrón.
Se ha podido comprobar que la masa del electrón aumenta con la velocidad, de acuerdo con las predicciones de la mecánica relativista. También ha sido verificada la naturaleza ondulatoria del electrón.
La producción de electrones libres por diferentes
procedimientos y su comportamiento en medios diversos han encontrado una
extraordinaria aplicación práctica y han hecho desarrollar una nueva rama de la
física y de la electricidad, la electrónica.
Los valores admitidos de la carga eléctrica y la masa del
electrón son e = -1,602 189 2 (46) × 10-19 C, y me = 9,109 354 (47) × 10-31 kg.

5) Neutrones:
Un
neutrón es una partícula subatómica contenida en el núcleo
atómico. No tiene carga eléctrica neta, a diferencia de carga
eléctrica positiva del protón.
El número de neutrones en un núcleo
atómico determina el isótopo de
ese elemento.
Descubrimiento del neutrón.
El primer indicio de la existencia del neutrón se produjo
en 1930, cuando Walther Bothe y Becker, H. encontró que cuando la radiación
alfa cayó sobre elementos como el litio y boro una nueva forma de radiación fue
emitido.
Inicialmente, esta radiación se cree que es un tipo de
radiación gamma, pero era más penetrante que cualquier radiación gamma
conocido. El trabajo realizado por Irene Joliot-Curie y Joliot Frederic en
1932, aunque no refuta la hipótesis de la radiación gamma, no todo lo soporta
bien.
En 1932, James Chadwick demostró que estos resultados no
pueden ser explicados por los rayos gamma y propone una explicación alternativa
de partículas sin carga de aproximadamente el mismo tamaño que un protón.
Él fue capaz de verificar experimentalmente esta conjetura y así demostrar que
el neutrón existía.
Detalles de neutrones
El neutrón está formado por tres quarks, un quark up y
dos quarks abajo.
La masa del neutrón es ligeramente mayor que la del protón.
El neutrón no existe fuera largo del núcleo
atómico, sólo unos meros 885 segundos (15 minutos) en promedio.
Masa: 1.67492729 × 10-27 kg
Carga: 0
Spin: 1/2
Masa: 1.67492729 × 10-27 kg
Carga: 0
Spin: 1/2
Debido a que el neutrón tiene un espín 1/2, es un
fermión.









0 comentarios:
Publicar un comentario